Blanchiment des coraux: une histoire de défense immunitaire par Coral Biome
Olivier Detournay, un immunologiste qui a rejoint l’équipe de Coral Biome, travaille en étroite collaboration avec l’équipe de Virginia Weis à l’Université d’Oregon (OSU) et l’Institut Hawaiien de Biologie Marine (HIMB) pour comprendre les relations symbiotiques coraux-zooxanthelles et le blanchiment.
« L’union fait la force ». Ce dicton est sans doute bien plus vieux qu’on ne le pensait. Les coraux l’appliquaient déjà il y a des millions d’années, en tirant avantage de leur association avec les zooxanthelles pour couvrir les besoins énergétiques nécessaires à l’édification des récifs coralliens. Le deal est simple: l’hôte corallien héberge les zooxanthelles, leur fournissant ainsi une protection physique, en échange de quoi les algues, grâce à la photosynthèse, fournissent sucres, acides aminés et lipides aux coraux. Bien que cette relation symbiotique soit décrite depuis de nombreuses années, d’importantes zones d’ombre persistent pour comprendre les mécanismes cellulaires assurant la paix du ménage. Ces questions sont plus que jamais d’actualité depuis que les changements climatiques nous ont appris que ce couple, que l’on croyait stable, peut être perturbé, se soldant par les phases de blanchiment des coraux observés à travers le monde entier, et même dans nos aquariums.

Ce qui intriguait Olivier et ses collègues n’était pas de savoir pourquoi les coraux blanchissent, mais plutôt pourquoi ils ne blanchissent pas quand tout va bien! Après tout, il est logique de penser qu’un animal (les coraux) se débarrasse de microbes (zooxanthelles) par l’activation de son système immunitaire. En fait, le rôle du système immunitaire est un peu plus subtil que la simple destruction de tout organisme « étranger ». Son rôle est d’assurer l’intégrité de l’animal en mettant en œuvre non seulement des mécanismes de destruction de microbes pathogènes mais aussi de tolérance d’organismes bénéfiques. L’hypothèse est que les zooxanthelles sont capables d’induire leur tolérance immunitaire au sein des tissus du corail. Ce mécanisme est connu depuis de nombreuses années en médecine. De nombreux cancers, pour ne pas être détruits par le système immunitaire, forcent leur propre tolérance. L’agent de la malaria, Plasmodium falciparum, est un autre exemple d’induction de tolérance permettant aux parasites d’échapper au système immunitaire de son hôte.
Un des mécanismes impliqué dans les phénomènes de tolérance repose sur l’augmentation d’un facteur soluble anti-inflammatoire (TGFbeta) induite par le parasite chez l’hôte infecté. Cette activité anti-inflammatoire favorise la prolifération des parasites jusqu’à déclencher la maladie. Ce qui est intéressant, est que d’un point de vue évolutif, les zooxanthelles sont des cousines très proches de Plasmodium, tout deux appartenant au groupe des alvéolés. L’idée de départ était donc que les zooxanthelles pourraient utiliser un mécanisme d’induction de tolérance similaire pour assurer leur relation symbiotique avec le corail.
Une première découverte d’Olivier et ses collègues est que la grande majorité des gènes indispensables à l’activation du facteur anti-inflammatoire TGFb sont très anciens et sont présents chez les coraux.
D’autre part, des expériences fonctionnelles chez l’anémone Aiptasia pallida, un modèle très étudié en laboratoire pour comprendre la physiologie des coraux, ont permis de conforter leur hypothèse. Ainsi, il est possible d’éviter le blanchiment de l’anémone soumise à un choc thermique de 34°C si l’on suractive le facteur TGFb (Fig. 1). Ceci montre que la voie TGFb est nécessaire pour le maintien de la relation symbiotique.
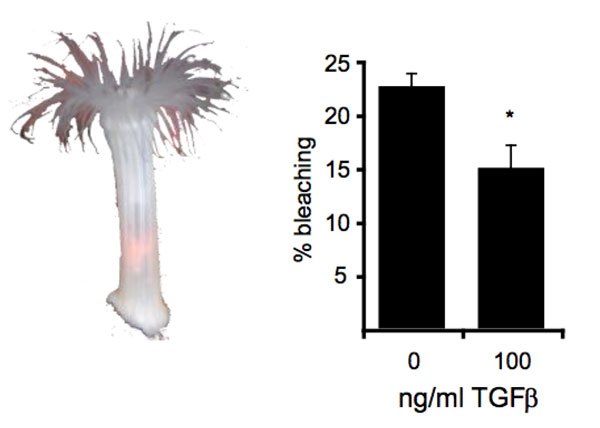
Figure 1. A gauche, Aiptasia pallida blanchie lors d’une expérience après un choc thermique. A droite, le prétraitement d’Aiptasia pallida avec 100 ng/ml de TGFb diminue le taux de blanchiment de l’anémone soumise à un choc thermique.
A l’inverse, bloquer l’action du TGFb a pour effet de perturber la relation symbiotique, menant au rejet des zooxanthelles (Fig. 2).
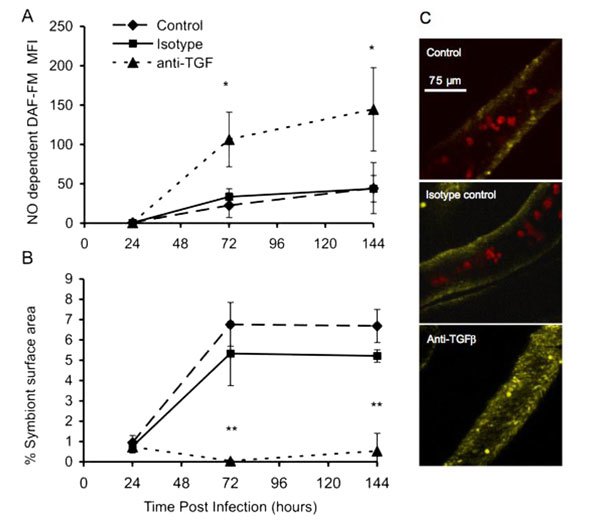
Figure 2. Le blocage de la voie du TGFb chez Aiptasia pallida inhibe leur colonisation par des zooxanthelles. (A) Dès 72 h après l’exposition des anémones avec des zooxanthelles, on observe une suractivation du système immunitaire lorsque le TGFb est bloqué (fins pointillés). ( B )Ce qui est associé à une diminution du taux de colonisation des anémones par les zooxanthelles. ( C ) Les photos prisent par microscopie confocale montrent l’aspect des tentacules d’anémones traitées ou non avec l’anti-TGFb. Les points rouges sont les zooxanthelles tandis que la fluorescence jaune démontre la présence d’oxide nitrique, signe d’une activation du système immunitaire.
Cette étude ouvre les portes de la compréhension physiologique des relations symbiotiques, dont celles des coraux devant faire face à des changements climatiques sans précédent. Ceci permettra, si les efforts consentis sont poursuivis, de mieux appréhender les problèmes récurrents de blanchiment et de pourquoi pas, apporter des solutions à moyen terme. Par ailleurs, l’étude de mécanismes immunitaires très complexes tels que ceux orchestrés par la voie de signalisation du TGFb vient peut-être de trouver un nouveau modèle expérimental animal. Les domaines d’applications médicales de ces découvertes sont nombreux, incluant la mise en évidence de molécules pouvant limiter les cas de rejets de greffes d’organes, d’augmenter l’efficacité de vaccins ou pour lutter contre le cancer. Affaire à suivre de très prêt…
Référence
Detournay O, Schnitzler CE, Poole A, Weis VM. Regulation of cnidarian-dinoflagellate mutualisms: Evidence that activation of a host TGFb innate immune pathway promotes tolerance of the symbiont. Developmental & Comparative Immunology. 2012 Sep 22.
Source: Site web Coral Biome




