HQI versus LED par Coral Biome
Eclairages et spectres d’absorption
L’éclairage est l’élément crucial à la vie et à la calcification des coraux. C’est cette source d’énergie qui permet la réalisation de la photosynthèse par les dinoflagellés symbiotiques (zooxanthelles). Cette réalisation met en jeu l’utilisation d’un ensemble de molécules dont les pigments photosynthétiques. Les dinoflagellés possèdent des chlorophylles a et c2 ainsi que des caroténoïdes (dont la péridinine spécifique à ces organismes). Ces molécules absorbent certaines radiations dites actives pour la photosynthèse (PAR pour Photosynthetically Active Radiation) (Figure 1).
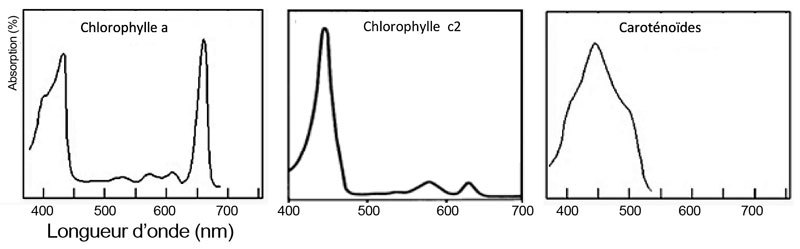
Figure 1. Spectre d’absorption de la chlorophylle a, c2 et des caroténoïdes (d’après Fawley, 1989 et http://www.snv.jussieu.fr/bmedia/Photosynthese/exp233.html).
Mesure des radiations actives de la photosynthèse (PAR)
D’après la loi de Stark-Einstein, la photosynthèse débute lorsqu’un photon excite un électron. En 1972, Keith Mc Cree découvre qu’en comptant les photons d’un rayonnement lumineux il peut mesurer le taux de photosynthèse. Alors que la mesure en lumens est un très bon indicateur de l’intensité lumineuse perçue par la vision humaine, le rendement photosynthétique est mesuré avec un PAR-mètre (PAR pour Phosysnthetically Active Radiation). Cet instrument mesure le nombre de photons en μmol/m²s, présent entre 400 et 700 nm, pouvant être absorbés par les organismes photosynthétiques. La mesure en PAR donne une première indication de l’efficacité photosynthétique d’une source lumineuse, mais celle-ci a des limites. En effet, c’est le PUR ou rayonnement utilisable pour la photosynthèse (Photosynthetically Usable Radiation), qui est la fraction de PAR réellement absorbée par les organismes étudiés, ici les dinoflagellés.
Les différentes technologies d’éclairages
Il existe actuellement trois principales technologies d’éclairages pour l’aquaculture : les lampes dites «HQI», les rampes à «LED» et les tubes fluorescents. Dans le cadre de cette étude, seules les deux premières sont comparées.
La technologie des lampes HQI est reconnue depuis les années 90 par les aquariophiles élevant des coraux durs comme l’une des meilleures sources d’éclairage. Une lampe HQI (Hydrargyrum Quartz Iodide) est une ampoule de verre remplie d’un gaz nommé halogénure métallique, alimentée par un transformateur à décharge. Une tension alternative appliquée aux bornes des électrodes donne naissance à un champ électrique entre celles-ci. Le gaz rare permet à la décharge ainsi qu’au régime d’arc de s’établir.
Comme le montre la Figure 2A, le spectre lumineux d’une ampoule HQI conçue pour bassins récifaux (ici une Giesmann® Marine Megachrome 12 500°K) possède un pic entre 400 et 450 nm, favorisant la photosynthèse. Cependant, ce type de source lumineuse possède un spectre lumineux non continu. Il comporte des raies, c’est-à-dire certaines bandes de longueurs d’onde très étroites donnant une lumière moins naturelle.
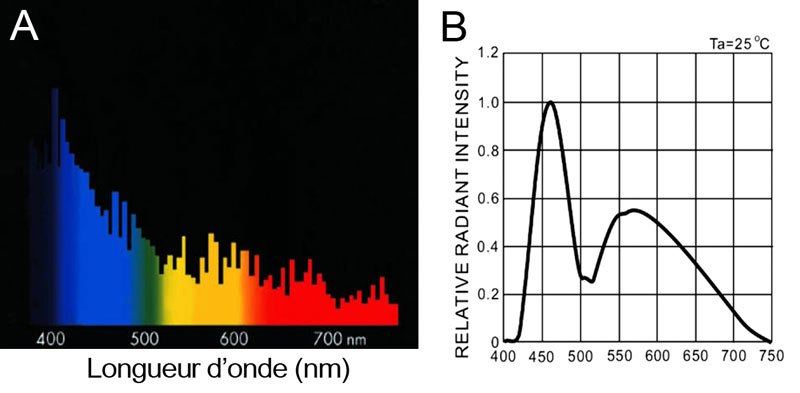
Figure 2. Spectre lumineux de l’ampoule HQI 150 watts Giesmann® (A) et des LED Alphéus® ( B ).
Les rampes à LED (Light Emitting Diode) destinées à l’aquarium récifal sont apparues il y a quelques années et commencent à devenir abordables pour les particuliers. Une LED est un composant électronique capable d’émettre de la lumière lorsqu’il est parcouru par un courant électrique. Le spectre des LED AlphéusTM est composé de deux pics, un premier plus étroit se situant à environ 455 nm (Figure 2B). Il s’agit de l’émission fondamentale de la LED, favorisant la photosynthèse. Le deuxième pic est une réponse du phosphore déposé sur la LED. Elle permet de donner par addition des couleurs un rendu final « blanc naturel » à la lumière. Enfin, contrairement aux HQI, le spectre est continu, émettant toutes les longueurs d’onde, comme pour le soleil.
Le faible recul par rapport à l’utilisation récente des LED en aquariophilie marine ne permet pas aujourd’hui d’évaluer objectivement leur efficacité sur la croissance de coraux en captivité. Le but de cette étude est de comparer le taux de croissance des coraux soumis à ces deux sources d’éclairage et ainsi d’obtenir une estimation de l’efficacité des rampes à LED. Une méthode de prise de masse permettant le suivi de la calcification du squelette corallien a été utilisée en raison de sa sensibilité à toute modification dans le système.
Equipement expérimental
Pour étudier l’influence respective des technologies HQI et LED sur la croissance d’Acropora spp et Pocillopora spp, deux bassins de 80 litres ont été installés et équipés chacun d’un type d’éclairage. Ces deux bassins ont été connectés sur le même système de filtration, garantissant une qualité d’eau identique dans les deux conditions expérimentales. Une ampoule HQI Giesemann® (Marine Megacrome 12 500°K) de 150W et une rampe à LED de la technologie Alphéus® (double rampe 11m1001) ont été utilisées. La notice de la rampe à LED a permis de déduire un rendement théorique de 66 lm/W soit 12% supérieur à celui de l’éclairage HQI (59 lm/W). Afin que les deux sources d’éclairage émettent la même intensité lumineuse, la puissance de l’éclairage LED a volontairement été diminuée de 12%. Dans une première approche de la capacité photosynthétique de ces deux technologies, la quantité de PAR diffusée sur chaque bouture a été mesurée à l’aide d’un PAR-mètre (Apogee®). Les moyennes de 94,42 ± 11,56 μmol/m²s et 223,08 ± 39,89 μmol/m²s ont été obtenues pour les boutures placées, respectivement, sous HQI et LED.
Méthode de prise de masse
Avant de commencer les pesées, un temps d’acclimatation d’un mois a été respecté pour chaque bouture. La prise de masse des coraux obtenue chaque semaine a été exprimée en taux de croissance journalier (%.j-1), soumis soit à un éclairage LED, soit à un éclairage HQI. La masse immergée se définit comme la résultante de deux forces opposées, la masse et la poussée d’Archimède. Ces deux forces se compensent pour les organes ayant la même densité que l’eau de mer. C’est le cas pour les tissus et différents organes des coraux. Leur masse immergée dans l’eau de mer est donc proche de zéro. Inversement, le squelette calcaire possède une masse apparente positive. Ainsi, la mesure de la masse immergée, est avant tout une mesure de la masse du squelette dans l’eau salée
Résultats et discussion
Aucune différence significative entre les HQI et les LED n’a été observée sur la croissance des coraux utilisés dans cette étude (Figure 3). Lors de cette expérience, il est important de rappeler que ces coraux n’ont pas été nourris. La lumière fournie par ces deux technologies a donc permis de combler la majorité des demandes énergétiques nécessaires au développement et à la croissance des coraux. La révélation d’un taux de croissance journalier indique l’utilisation du processus de calcification. Or le produit photosynthétique est surtout utilisé par les coraux pour leur respiration, avec seulement une faible proportion pour leur croissance. Ces éclairages apportent donc une production d’énergie optimale à leur respiration et permet également une production de leur croissance.
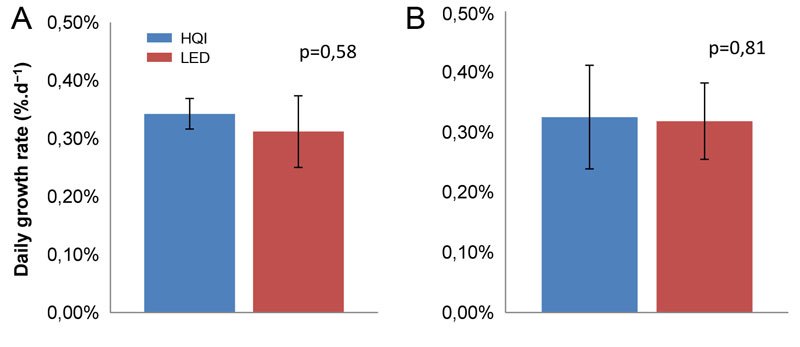
Figure 3. Comparaison des éclairages HQI et LED sur la croissance des Pocillopora spp (A) et Acropora spp ( B ). Les résultats expriment des taux de croissance journaliers moyens (%.j-1) ± l’écart-type. Ceux-ci ont été calculés à partir de quatre boutures pour chaque condition expérimentale, durant une période de 35 jours
En ce qui concerne l’estimation en PAR, il a été déterminé que la rampe à LED possède un rendement deux fois supérieur à celui de la lampe HQI, malgré une intensité en lumen équivalente. Ceci s’explique sans doute par le fait que les LED ont un spectre continu, contrairement à celui des HQI qui comporte des raies étroites négligeant certaines longueurs d’onde mesurées par le PAR-mètre.Les résultats obtenus dans cette étude montrent des taux de croissance identiques pour les deux types d’éclairages. Ceci laisse entrevoir deux explications possibles. Soit la quantité réelle des radiations utilisées par la photosynthèse (PUR) fournie par les deux éclairages est sensiblement équivalente, soit la capacité de photo-acclimatation des dinoflagellés permet de compenser cette différence de PAR. L’aspect plus foncé des boutures placées sous HQI (Figure 4A & 4 B ) indique une photo-acclimatation se traduisant par une augmentation de la concentration de pigments cellulaires, comme cela a été décrit dans plusieurs études scientifiques (voir les Références complémentaires).
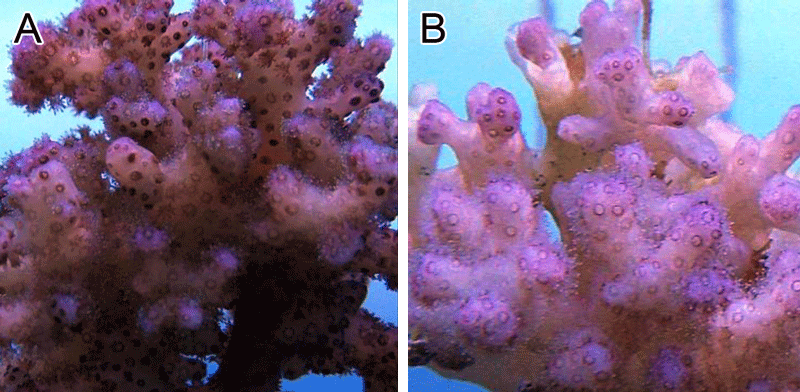
Figure 4. Pocillopora spp placé sous HQI (A) et sous LED ( B ).
Ces deux types d’éclairage fournissant majoritairement des longueurs d’ondes bleues , ces expériences confirment l’importance de cette couleur et la capacité de photo-acclimatation des dinoflagellés sous une lumière artificielle. Les dinoflagellés possèdent des pigments de chlorophylle a qui absorbent les longueurs d’ondes rouges (Figure 1). Ainsi, un éclairage émettant une quantité importante de longueurs d’ondes rouges en plus des longueurs d’ondes bleues a probablement une influence positive non négligeable sur la croissance corallienne en captivité.
Afin d’aider au choix du type d’éclairage le plus adapté au besoin d’une aquaculture, il est nécessaire de tenir compte de la différence de consommation énergétique. La technologie LED possède un rendement énergétique supérieur à celui des HQI. En plus d’être «écologique» et moins coûteuse à l’utilisation, celle-ci a de nombreuses autres qualités telle qu’une durée de vie plus longue et un dégagement thermique moindre. Par ailleurs, la souplesse d’utilisation des LED est rendue possible grâce au pilotage par ordinateur. Elle permet facilement la mise en place de gradations lumineuses, offrant la possibilité de mimer les conditions naturelles en augmentant et diminuant progressivement l’intensité ou en simulant des journées nuageuses.
Nous remercions tout particulièrement Jean-Louis Cuquemelle, concepteur des rampes Alphéus, pour avoir très aimablement répondu présent et pour sa collaboration experte dans le domaine des éclairages LED. Jeremy Berthelier, étudiant en Licence de Biologie, est également chaleureusement remercié pour l’ensemble du travail qu’il a réalisé au cours de cette étude, depuis la mise en place des systèmes expérimentaux jusqu’au suivi des croissances ainsi que sa participation à la rédaction de cet article.
Références complémentaires
- Allemand D., Ferrier-Pagès C., Furla P., Houlbrèque F., Puverel S., Reynaud S., Tambutté E., Tambutté S., Zoccola D., 2004. Biomineralisation in reef-building corals: from molecular mechanisms to environmental control, Palevol, 3:453–467.
- Falkowski P. G., Dubinsky Z, 1981. Light-shade adaptation of Stylophora pistillata, a hermatypic coral from the Gulf of Eilat. Nature, 289 :172-174.
- Falkowski P. G., Dubinsky Z., Muscatine L., Porter J. W, 1984. Light and the bioenergetics of a symbiotic coral. BioScience, 34 :705-709.
- Falkowski P. G., Jokiel P. L., Kinzie R. A. III, 1990. Irradiance and corals. Ecosystems of the world #25: coral (ed Dubinsky Z.), Elsevier Press., 89-106.
- Fawley, Marvin W., 1989. A New Form Of Chlorophyll C Involved In Light-Harvesting. Plant Physiol., American Society of Plant Biologists, 91:727-732.
- Grosjean Ph., Spirlet Ch., Jangoux M., 1999. Comparison of three body-size measurements for echinoid, Echinoderm Research (ed M.D. Candia Carnevali et F. Bonasoro), 31-35.
- Jokiel P. L., Maragos J. E., Franzisket L., 1978. Coral growth: buoyant weight technique. UNESCO, Coral reefs: research methods, 529–541.
- Mass T., Kline D. I., Roopin M., Veal C. J., Cohen S., Iluz D. and Levy O., 2010. The spectral quality of light is a key driver of photosynthesis and photoadaptation in Stylophora pistillata colonies from different depths in the Red Sea. The Company of Biologists Ltd, The Journal of Experimental Biology, 213:4084-4091.
Source : Blog Coral Biome




